Содержание:
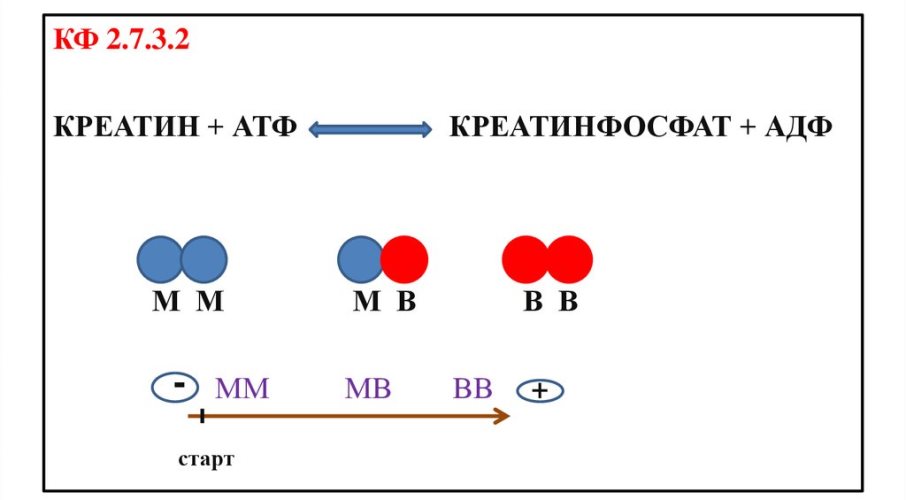
Креатинкиназа — фермент, связанный с восстановлением содержания и хранением АТФ (энергетическая валюта клетки). Катализирует следующую реакцию: Креатин + АТФ Креатинфосфат + АДФ, что позволяет организму хранить энергию фосфата в виде креатинфосфата. Энергия освобождается для в ходе обратной реакции, которую запускает снижение АТФ.
Источники КФК в сыворотке крови
- Скелетная мышца
- Сердце
- Головной мозг
Определение креатинкиназы в сыворотке крови используют в диагностике и мониторинге инфаркта миокарда (ИМ) и прогрессирующей мышечной дистрофии Дюшенна. При остром ИМ, креатинфосфокиназа освобождается из поврежденных клеток миокарда.
Нормы креатинкиназы
Мужчины
6-11 лет: 150-499 Ед / л12-17 лет: 94-499 Ед / л
> или = 18 лет: 52-336 Ед / л
Женщины
6-7 лет: 134-391 Ед / л8-14 лет: 91-391 Ед / л15-17 лет: 53-269 Ед / л
> или = 18 лет: 38-176 Ед / л
Исходные значения уровней креатинкиназы не установлены для детей младше 6 лет.
Примечание: Энергичные упражнения или внутримышечные инъекции могут вызвать кратковременное повышение КК.
Расшифровка показателей КФК
Креатинкиназа в сыворотке значительно повышена при дистрофии мышц и особенно при дистрофии Дюшенна, при которой уровни КФК могут в 50 раз превышать верхнюю границу нормы. При прогрессирующей мышечной дистрофии содержание фермента в сыворотке крови самое высокое у младенцев и детей (7-10 лет). Уровень фермента повышается задолго до клинического проявления болезни. Достаточно высокие значения креатинфосфокиназы отмечены при вирусном миозите, полимиозите и подобных заболеваниях мышц. Тем не менее, при болезни Паркинсона содержание фермента в сыворотке крови в норме. Очень высокий уровень а фермента встречается при злокачественной гипертермии.
Ранний подъем креатинкиназы наблюдается после острого инфаркта миокарда, пик достигается через 12 — 24 часа и падает обратно до нормы через 3 — 4 дня.
Структура креатинфосфокиназы
Молекула фермента состоит из двух субъединиц (две полипептидные цепи, каждая из которых образует глобулу, синтезируются разными генами). Две субъединицы образуют 3 молекулярные формы или 3 изофермента:
- КК-BB: (КK-1) — мозговой тип. При электрофорезе перемещается быстрее двух других изоферментов, отсюда КК-1
- КK-MB: (КK-2) — гибридный тип. Содержат сердце, скелетные мышцы
- КK-MM: (КK-3) — мышечный тип.
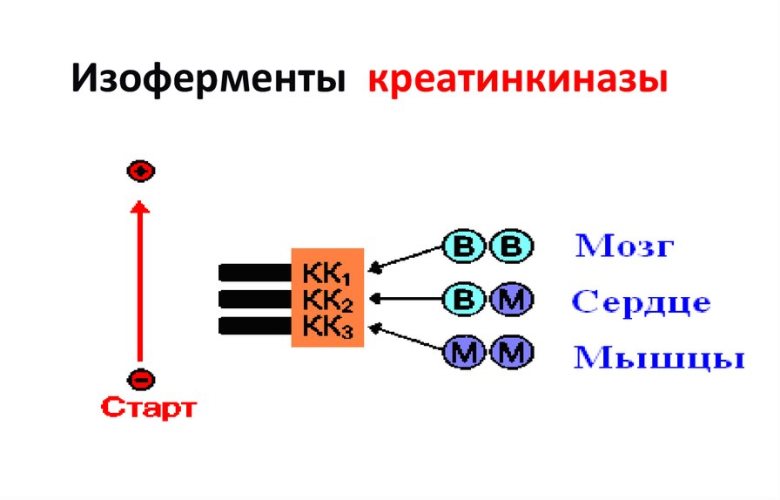
Изоферменты катализируют одну и туже реакцию, но их оптимальная активность зависит от условий в органе или ткани.
В лабораторной практике определяют общую активность креатинкиназы и содержание отдельных изоферментов. Так, при инфаркте миокарда повышение общей активности фермента связано с изоферментом КК-МВ, а при заболеваниях скелетных мышц — КК-ММ.
Хотя общая активность креатинкиназы используется в качестве диагностического теста для инфаркта миокарда, тест не заменяет иммунологические тесты на тропонин Т и I — золотой стандарт диагностики ИМ. Активность КФК в сыворотке повышается у больных с острым нарушением мозгового кровообращения (инсульт), при нейрохирургических операциях и при ишемии головного мозга (КК-ВВ)
Активность КК в сыворотке крови обратно связана с активностью щитовидной железы. Около 60% пациентов с гипотиреозом имеют активность КК, которая в 5 раз превышает верхнее значение диазона нормы.
Предостережения
Упражнение и мышечные травмы (контактные виды спорта, дорожно-транспортные происшествия, внутримышечные инъекции, хирургия, конвульсии, укусы ос или пчел и ожоги) могут повысить сывороточные значения креатинкиназы.