Содержание:
Тучные клетки (mast cell, MC)
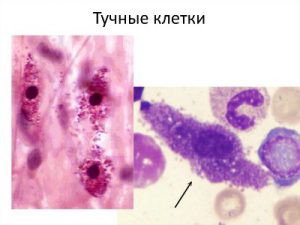 Тучные клетки (ТК) являются тканевыми воспалительными клетками гемопоэтического происхождения, которые реагируют на сигналы врожденного и адаптивного иммунитета немедленным и отсроченным высвобождением медиаторов воспаления. Они расположены в основном вблизи кровеносных сосудов и на эпителиальных поверхностях. ТК — центральные клетки в патогенезе заболеваний немедленной гиперчувствительности и мастоцитоза, но также участвуют в ответах хозяев на патогены, аутоиммунные заболевания, фиброз и заживление ран.
Тучные клетки (ТК) являются тканевыми воспалительными клетками гемопоэтического происхождения, которые реагируют на сигналы врожденного и адаптивного иммунитета немедленным и отсроченным высвобождением медиаторов воспаления. Они расположены в основном вблизи кровеносных сосудов и на эпителиальных поверхностях. ТК — центральные клетки в патогенезе заболеваний немедленной гиперчувствительности и мастоцитоза, но также участвуют в ответах хозяев на патогены, аутоиммунные заболевания, фиброз и заживление ран.
Морфология и фенотип
ТК имеют диаметр до 20 мкм, яйцевидные или нерегулярно удлиненные клетки с яйцевидным ядром, содержат обильные метахроматические цитоплазматические гранулы. Метахроматическая окраска гранул обусловлена обильными сульфатированными протеогликанами (например, гепарином и хондроитинсульфатом).
ТК человека делятся на 2 основных подтипа по содержанию фермента триптазы триптазосепецифические клетки (MC T- клетки) и химазы, химазоспецифические клетки (MC TC- клетки), каждый подтип преобладает в разных тканях. Триптаза — основной маркер всех тканевых ТК.
MC T-клетки представляют собой преобладающий тип ТК в слизистой оболочке дыхательного и желудочно-кишечного трактов, их количество увеличиваются при воспалении слизистой оболочки.
MC TC-клетки локализуются в соединительных тканях, таких как дерма, подслизистая оболочка желудочно-кишечного тракта, сердце, конъюнктивы и периваскулярные ткани.
На поверхности всех ТК экспрессированы рецептор для фактора роста тучных и стволовых клеток (SCF) CD117 и высоко аффинный рецептор к Fc фрагменту IgE — FcεR1. В зависимости от их локализации, стадии дифференцировки и активации они экспрессируют другие рецепторы клеточной поверхности. В том числе рецепторы к интерлейкинам: IL-3R, IL-4R, IL-5R, IL-9R, IL-10R, GM-CSFR, IFN-γR, CCR3, CCR5, CXCR2, CXCR4, рецептор фактора роста нервов и Toll-подобные рецепторы (TLRs).
Развитие и пути миграции в ткани у человека
 Тучные клетки человека возникают из CD34 + плюрипотентных клеток-предшественников. Предшественники ТК циркулируют в крови, затем попадают в ткани, где они созревают. Созревание предшественников в тканях зависит от SCF, который связывается с CD117.
Тучные клетки человека возникают из CD34 + плюрипотентных клеток-предшественников. Предшественники ТК циркулируют в крови, затем попадают в ткани, где они созревают. Созревание предшественников в тканях зависит от SCF, который связывается с CD117.
Содержание ТК увеличиваются в несколько раз при IgE-зависимых реакциях немедленной гиперчувствительности, включая ринит, крапивницу и астму; заболевания соединительной ткани, такие как ревматоидный артрит; инфекционные заболевания, такие как паразиты; неопластические заболевания, такие как лимфома и лейкемия, остеопороз, хроническое заболевание печени и хроническое заболевание почек. Наиболее выраженное увеличение тучных клеток происходит при паразитарных заболеваниях и при мастоцитозе (связанном с мутациями с усилением функции тирозинкиназы рецептора CD117). Мутации, связанные с потерей ферментативной функции CD117 – рецепторная тирозинкиназа, обусловливают развитие витилиго (белые и гипопигментированные пятна кожи) из-за дефектной миграции меланоцитов, но не приводят к значительной патологии у большинства пациентов, например, к повышению восприимчивости к инфекции или аутоиммунным заболеваниям. Вопрос о том, каким образом тучные клетки из кровотока поселяются в той или иной ткани, остаётся открытым.
Активация
Иммунные комплексы поливалентных антигенов и специфических IgE распознаются и связываются FcεR1 на поверхности ТК и активируют их. Такая активация является основой анафилаксии и других аллергических заболеваний. Плотность FcεR1 на поверхности ТК повышается в присутствии повышенных уровней свободного IgE и в присутствии IL-4, тем самым усиливая активацию. Кроме того, тучные клетки активируются продуктами активации комплемента C3a и C5a-C3aR и C5aR (CD88), фактором роста нервов через TRKA и IgG через FcγR1. Тучные клетки также активируются через Tool рецепторы. Например, активация через TLR3 с помощью двух цепочечной РНК индуцирует в ТК человека синтез интерферона-γ. Степень и структура выпущенных медиаторов зависят от сигнала, его интенсивности и среды цитокинов. Например, релиз посредника усиливается в присутствии SCF.
Медиаторы и эффекторная функция
Медиаторы (посредники), продуцируемые ТК, делятся на предварительно сформированные (преформированные), недавно синтезированные липидные медиаторы и цитокины / хемокины. Эти категории не являются абсолютно исключительными, поскольку по крайней мере один цитокин, TNF-α, встречается как предварительно сформированная так и как недавно синтезированная молекула.
Преформированные медиаторы, включая гистамин, сериновые протеазы (триптаза и химаза), карбоксипептидазу А и протеогликаны, хранятся в цитоплазматических гранулах. Протеогликаны, в том числе гепарин и хондроитинсульфаты из-за их отрицательного заряда образуют комплексы с гистамином, протеазами и другим содержимым гранул. После активации ТК гранулы сливаются с плазматической мембраной и содержимое высвобождается во внеклеточную среду в течение нескольких минут. Гистамин гранул диссоциирует из протеогликанов во внеклеточную жидкость путем обмена с ионами натрия. Гистамин оказывает влияние на гладкие мышцы (сокращение), эндотелиальные клетки, нервные окончания и секрецию слизистой. Во внеклеточной жидкости период полураспада гистамина около 1 минуты. Он подвергается ферментативному распаду с образованием нескольких конечных продуктов, преобладающим среди них является N – метилгистамин. Определение его содержания в суточной моче используется для скрининга и мониторинга активации ТК.
 Большая часть белка в гранулах состоит из нейтральных протеаз: триптазы в MC T- клетках и триптаза, химазы, катепсина G и карбоксипептидазе в MC TC-клетка. Триптаза постоянно секретируется ТК человека. Секреторная триптаза состоит в основном из бета-протриптазы (незрелая бета-триптаза) и альфа-протриптазы. Исходная сыворотка состоит в основном из секретируемых протриптаз, которые были конститутивно секретированы из тучных клеток; их уровень, как полагают, отражает нагрузку на тучные клетки и повышен при системном мастоцитозе. Заметное увеличение общей триптазы после анафилактического эпизода связано с дополнительным высвобождением зрелой β-триптазы. Пик содержания триптазы наблюдается примерно через час после анафилаксии, повышенные уровни могут сохраняться в течение нескольких часов после проявления анафилаксии, в отличие от гистамина, который снижается до исходного уровня через 1 час. Анафилаксия вызванная лекарственным средствам и ядом насекомых связана с повышенными уровнями триптазы, тогда как анафилаксия для пищевых продуктов, часто не сопровождается повышенными уровнями триптазы в сыворотке. Функция триптазы in vivo неизвестна, но in vitro она расщепляет фибриноген, фибронектин, проурокиназу, матричную прометаллопротеазу-3 (proMMP-3), протеаз-активированный рецептор-2 (PAR2) и компонент комплемента C3. Триптаза может активировать фибробласты, способствовать накоплению воспалительных клеток и потенцировать гистамин-индуцированную бронхоспаз.
Большая часть белка в гранулах состоит из нейтральных протеаз: триптазы в MC T- клетках и триптаза, химазы, катепсина G и карбоксипептидазе в MC TC-клетка. Триптаза постоянно секретируется ТК человека. Секреторная триптаза состоит в основном из бета-протриптазы (незрелая бета-триптаза) и альфа-протриптазы. Исходная сыворотка состоит в основном из секретируемых протриптаз, которые были конститутивно секретированы из тучных клеток; их уровень, как полагают, отражает нагрузку на тучные клетки и повышен при системном мастоцитозе. Заметное увеличение общей триптазы после анафилактического эпизода связано с дополнительным высвобождением зрелой β-триптазы. Пик содержания триптазы наблюдается примерно через час после анафилаксии, повышенные уровни могут сохраняться в течение нескольких часов после проявления анафилаксии, в отличие от гистамина, который снижается до исходного уровня через 1 час. Анафилаксия вызванная лекарственным средствам и ядом насекомых связана с повышенными уровнями триптазы, тогда как анафилаксия для пищевых продуктов, часто не сопровождается повышенными уровнями триптазы в сыворотке. Функция триптазы in vivo неизвестна, но in vitro она расщепляет фибриноген, фибронектин, проурокиназу, матричную прометаллопротеазу-3 (proMMP-3), протеаз-активированный рецептор-2 (PAR2) и компонент комплемента C3. Триптаза может активировать фибробласты, способствовать накоплению воспалительных клеток и потенцировать гистамин-индуцированную бронхоспаз.
Тучные клетки, активированные через FcεRI или CD117, быстро синтезируют эйкозаноидные медиаторы из эндогенной арахидоновой кислоты мембран. Арахидоновая кислота, высвобождаемая фосфолипазой А2, превращается ферментами циклооксигеназой (СОХ) и простагландин синтазой D в простагландин D2 (PGD2) (не продуцируется базофилами); или 5-липоксигеназой и белком, активирующим 5-липоксигеназу до LTA4, который превращается в LTB4 или конъюгирован с глутатионом с образованием LTC4 — хематтрактантов нейтрофилов и эффекторных Т-клеток. Цистеиновые лейкотриены — CysLT1 и CysLT2 проявляют активность мощных бронхоконстрикторов способствуют проницаемости сосудов, индуцируют продукцию слизи и привлекают эозинофилы. PGD2 также является бронхоконстриктором, привлекает эозинофилы и базофилы; а его активный метаболит (9α, 11β-PGF2) является констриктором коронарных артерий.
TNF-α является основным цитокином, который хранится и высвобождается тучными клетками. Он активирует молекулы адгезии эндотелия и эпителия, увеличивает бронхиальную реакцию и оказывает противоопухолевое действие. Другие цитокины, продуцируемые тучными клетками, включают IL-3, GM-CSF и IL-5, которые имеют решающее значение для развития и выживаемости эозинофилов, IL-6, IL-10 и IL-13. Человеческие тучные клетки также продуцируют несколько хемокинов, включая CXCL8 (IL-8) и CCL3 (макрофагальный воспалительный белок 1α (MIP1α)).
Роль тучных клеток в здоровье и болезни
Считается, что ТК функционируют в гомеостазе, включая заживление ран, и во врожденном и адаптивном иммунитете. Заболевания, связанные с тучными клетками, включают те, которые вызваны внешними механизмами, такими как IgE-опосредованные заболевания, действующие через рецепторы FcεR1 на тучных клетках или прямыми активаторами ТК, действующими через другие рецепторы, и те, которые вызваны внутренними нарушениями ТК, прежде всего мастоцитоз и недавно описанный синдром активации моноклональных тучных клеток.
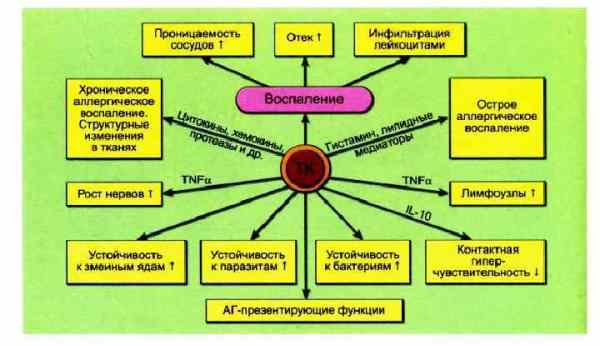
Активация тучных клеток через FcεR1 играет центральную роль в патогенезе аллергических заболеваний, включая анафилаксию, аллергический ринит и аллергическую астму. Активация FcεR1 поливалентным аллерген-IgE, приводит к инициированию немедленной реакции гиперчувствительности, а также к реакции поздней фазы. Непосредственная реакция определяется освобождением предварительно сформированных медиаторов и быстро синтезируемыми липидными медиаторами и приводит к: эритеме, отеку и зуду в коже; чиханию и ринорее в верхних дыхательных путях; к кашлю, бронхоспазму, отеку и слизистой секреции в нижних дыхательных путях; тошноте, рвоте, диарее и коликам в желудочно-кишечном тракте; гипотонии. Поздние фазовые реакции опосредуются цитокинами и хемокинами и могут возникать через 6-24 часа после немедленной реакции.
Патологический избыток тучных клеток, особенно в коже, костном мозге, желудочно-кишечном тракте, селезенке, печени и лимфатических узлах, обычно вызванный активизацией рецепторной тирозинкиназы (KIT приводит к мастоцитозу. Мастоцитоз может возникать в любой возрастной группе, и в большинстве случаев впервые подозревается из-за появления фиксированных пигментных поражений кожи, пигментной крапивнице, для которой характерен симптом Дарье – образование волдыря при поглаживании красно-коричневых высыпаний на коже. Клиническая презентация может также включать необъяснимые приливы жара к лицу и гипотонию. Мастоцитоз варьируется от невыраженных форм до мастоцитоза, связанного с патологией костного мозга, включая миелодисплазию. Установлены диагностические критерии для заболевания и включают характерные данные о кожных проявлениях, увеличенном исходном уровне в сыворотки крови триптазы и конкретных результатах исследования костного мозга. Кожный мастоцитоз диагностируется на основе типичных поражений кожи с мультифокальными или диффузными инфильтратами ТК при биопсии и отсутствием диагностических критериев, достаточных для диагностики системного мастоцитоза (СМ). СM диагностируется на основании наличия основного и второстепенных критериев. Основным критерием является наличие мультифокальных плотных инфильтратов с> = 15 тучных клеток с высокой степенью мощности в костном мозге и / или других органах. Малыми критериями являются:
- В биоптатах костного мозга или других органов (не кожи)> 25% тучных клеток имеют форму веретена или атипичную морфологию, или в мазках аспирата костного мозга содержатся только ТК,> 25% являются нетипичными или зрелыми;
- Обнаружение мутационной активации в кодоне 816 KIT в костном мозге, крови или другом вне кожном участке;
- Тучные клетки в костном мозге, крови или других органах (не в коже), экспрессируют CD2 и / или CD25, в дополнение к нормальным маркерам тучных клеток;
- Общая триптаза в сыворотке постоянно превышает 20 нг / мл (если не существует связанного клонального миелоидного расстройства, и в этом случае этот параметр недействителен). Наличие основного критерия и одного незначительного критерия или наличие по крайней мере 3 незначительных критериев достаточно диагностики для СМ.
Синдром активации моноклональных ТК представляет собой недавно описанный синдром, характерный для пациентов с идиопатической анафилаксией или системной анафилаксией к укусам пчел, которые обнаруживают при биопсии костного мозга по меньшей мере два малых критерия для СМ, но не имеют кожных проявлений. Аномалии формы ТК, популяции клональных тучных клеток характерны для этого заболевания. Хотя оптимальное лечение не определено, диагноз cиндром активации моноклональных ТК должен рассматриваться у пациентов с идиопатической анафилаксией.