Содержание:
Нейтрофилы (полиморфноядерныe лейкоциты, ПЯЛ)
Нейтрофилы — это подвижные фагоциты с сегментированным ядром. Нейтрофилы идентифицируют либо по структуре ядра, либо по поверхностному антигену CD66.
 Основную роль в эффекторных функциях нейтрофилов играют компоненты гранул. Гранулы нейтрофилов классифицируют на первичные, вторичные, третичные и секреторные пузырьки. Различия между классами гранул могут быть определены после анализа белков-маркеров. В гранулах нейтрофилов сохраняется около 300 различных белков, которые могут быть освобождены в окружение клетки или оставаться присоединенными к мембране нейтрофилов.
Основную роль в эффекторных функциях нейтрофилов играют компоненты гранул. Гранулы нейтрофилов классифицируют на первичные, вторичные, третичные и секреторные пузырьки. Различия между классами гранул могут быть определены после анализа белков-маркеров. В гранулах нейтрофилов сохраняется около 300 различных белков, которые могут быть освобождены в окружение клетки или оставаться присоединенными к мембране нейтрофилов.
Секреторные пузырьки
Считают, что секреторные пузырьки формируются только в зрелых сегментоядерных нейтрофилах при поступлении их в кровоток. Секреторные пузырьки по происхождению эндосомы, и представляют собой пул рецепторов, включаемых в плазматическую мембрану после слияния мембраны секреторных пузырьков с мембраной нейтрофила. В мембране секреторных пузырьков множество рецепторов — β2-интегрины, Cr1, рецепторы формил-пептида (fpr), CD14, CD16, а также ферменты металлопротеиназы и щелочная фосфатаза. В полости секреторных пузырьков содержится альбумин и белок, связывающий гепарин (HBP). Маркерный фермент пузырьков — щелочная фосфатаза.
Вторичные и третичные гранулы
Пероксидазонегативние гранулы нейтрофилов могут быть разделены на вторичные и третичные, которые отличаются содержанием белков и секреторными свойствами. Вторичные гранулы содержат больше антибактериальных соединений, чем третичные. Третичные гранулы легче, чем вторичные подвергаются экзоцитозу. Третичные гранулы – резерв матрикс-деградирующих ферментов и мембранных рецепторов, необходимых для экстравазации и диапедеза нейтрофила. Напротив, вторичные гранулы участвуют главным образом, в антибактериальных действиях нейтрофилов путем мобилизации в фагосомы или секрецию во внешнюю среду. В арсенале их антибактериальных пептидов — лактоферрин, NGAL, лизоцим и hCAP18, LL-37. Маркерный белок третичных гранул — фермент желатиназа, вторичных – лактоферрин.
Первичные гранулы
Первичные гранулы содержат кислые гидролазами, в том числе кислую фосфатазу и антибактериальные белки; их мембрана лишена рецепторов. У человека антибактериальные белки представлены нейтрофильными пептидами – α-дефензинами и сериновыми протеазами с антибактериальной активностью. При созревании нейтрофилов в костном мозге первыми еще на стадии миелобластов формируются азурофильные гранулы; дефензины (катионные белки) в азурофильных гранулах синтезируются на второй стадии дифференцировки нейтрофилов — стадии образования промиелоцитов.
Маркерный белок этих гранул фермент миелопероксидазы.
Моноциты/макрофаги
Моноциты – это фагоциты, которые циркулируют в крови. Когда моноциты мигрируют в ткани, они превращаются в макрофаги. Моноциты имеют характерную форму ядра в виде почки. Они могут быть определены морфологически или по CD14 – маркеру клеточной поверхности. В отличие от ПЯЛ они не содержат гранул, но имеют многочисленные лизосомы, содержимое которых похоже на содержимое гранул нейтрофилов. Специализированные виды макрофагов могут быть найдены во многих органах, включая легкие, почки, мозг и печень.
Макрофаги выполняют множество функций. Как мусорщики, они удаляют из организма изношенные клетки, иммунные комплексы. Макрофаги представляют чужеродный антиген для распознавания его лимфоцитами, в этом отношении макрофаги похожи на дендритные клетки. Макрофаги способны секретировать удивительное разнообразие мощных химических сигналов – монокинов, которые жизненно важны для иммунного ответа неспецифического иммунитета: ответ фагоцитов на инфекцию.
Циркулирующие в крови нейтрофилы и моноциты реагируют на сигналы опасности (SOS), образующиеся в месте локализации инфекции. SOS сигналы включают в себя N-формил-метионин, освобождаемый бактериями; пептиды, образующиеся при свертывании крови, растворимые пептиды – продукты активации системы комплемента и цитокины, секретируемые тканевыми макрофагами, которые столкнулись в тканях с бактериями. Некоторые из сигналов SOS стимулируют экспрессию молекул клеточной адгезии на эндотелиальных клетках неподалеку от места инфекции, такие как ICAM-1 и селектины. Молекулы адгезии связываются с комплементарными структурами на поверхности фагоцитирующих клеток. Как следствие нейтрофилы и моноциты прилипают к эндотелию. Вазодилататоры, освобождаемые в месте инфекции тучными клетками, способствуют диапедезу прилипших фагоцитов через эндотелиальный барьер » и миграции их к месту локализации инфекции. Перемещение в тканях по градиенту концентрации молекул SOS. Параллельно SOS сигналы активируют фагоциты, что приводит к усилению, как поглощения возбудителей, так и внутриклеточному уничтожению инвазивных организмов.
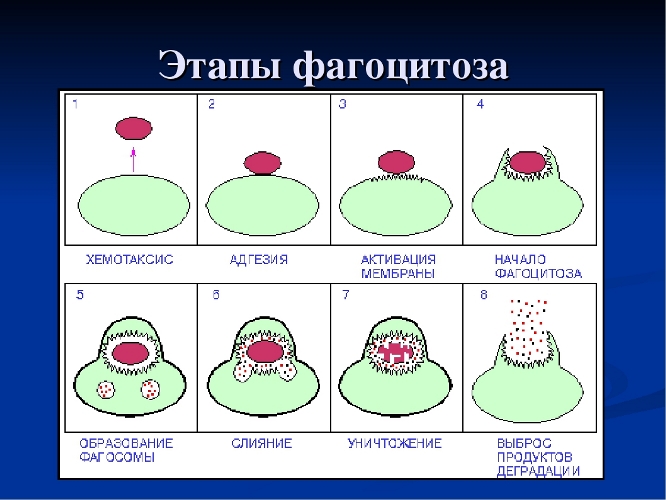
Инициирование фагоцитоза при неспецифическом иммунитете
Клетка — фагоциты имеет на своей мембране рецепторы, способствующие связыванию их с возбудителем-антигеном, и поглощать его. К важнейшим рецепторам относятся следующие структуры.
1. Fc-рецепторы — если с бактериями связываются антитела IgG , то на поверхности бактерий будут Fc-фрагменты, которые распознаются и связываются Fc- рецептором на фагоцитах. На поверхности одного нейтрофила содержится порядка 150 000 таких рецепторов! Связывание бактерий, покрытых IgG, инициирует фагоцитоз и активацию метаболической активности фагоцитов (респираторный взрыв).
2. Рецепторы комплемента — фагоциты имеют рецепторы для С3b компонента комплемента, При активации комплемента при взаимодействии со структурами поверхности бактерий, последняя покрывается гидрофобным фрагментом C3b. Связывание рецептора к C3b с С3b на приводит также к повышению фагоцитоза и стимулированию респираторного взрыва.
3. Рецепторы — мусорщики связывают широкий спектр полианионов на бактериальной поверхности, опосредуя фагоцитоз бактерий.
4. Toll-подобные рецепторы — фагоциты имеют различные Toll-подобные рецепторы, которые признают широкий спектр консервативных структур на поверхности инфекционных агентов. Связывание инфекционных агентов через Toll-подобных рецепторов приводит к фагоцитозу и высвобождению провоспалительных цитокинов (IL-1, TNF-альфа и IL-6) фагоцитами.
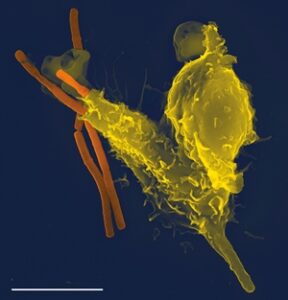
После прикрепления бактерий, мембрана фагоцитов образует псевдоподии, которые, в конце концов, окружают бактерию и поглощают её, бактерии оказывается заключенной в фагосому. Фагосомы сливаются с вторичными гранулами, образуя фаголизосому.
Респираторный взрыв и внутриклеточный киллинг при неспецифическом иммунитете
Во время фагоцитоза, фагоцитирующие клетки увеличивают потребление глюкозы и кислорода, этот процесс называют респираторный взрыв. Следствие респираторного взрыва – образование активных форм кислорода, которые способны убить бактерии в составе фаголизосомы. Этот процесс называют кислород-зависимый внутриклеточный киллинг. Кроме того, в составе фаголизосомы бактерии и могут быть уничтожены под действием уже имеющегося содержимого в гранулах. Комплекс этих реакций называют кислород независимый внутриклеточный киллинг.
1. В процессе фагоцитоза включается механизм прямого окисления глюкозо-6-фосфата в пентозофосфатном пути с образованием НАДФН. Тотчас осуществляется сборка надмолекулярного комплекса активной молекулы НАДФН-оксидазы. Активированная НАДФН-оксидаза использует кислород для окисления НАДФН. В результате реакции образуется супероксид-анион. Под действием супероксиддисмутазы часть супероксид-анионов превращается в синглетный кислород и H2O2 Другая часть супероксид-анионов взаимодействует с Н2О2 с образованием гидроксильных радикалов и синглетного кислорода. В результате всех этих реакций образуются токсичные кислорода соединений супероксид-анион перекись водорода, синглетный кислород и гидроксильные радикалы (ОН •).
2. Кислород зависимый миелопероксидаза-зависимый внутриклеточный киллинг. Как только азурофильные гранулы сливаются с фагосомой, в состав фаголизосомы высвобождается миелопероксидаза. Миелопероксидаза катализирует реакцию образования гипохлорит иона из H2O2 и хлорид иона. Гипохлорит иона высокотоксичное соединение, мощный окислитель. Некоторая часть гипохлорита может самопроизвольно распадаться до синглетного кислорода. В результате этих реакций образуются токсичные гипохлорит (OCl—) и синглетный кислород (1O2).
3. Реакции детоксикации
Нейтрофилы и макрофаги располагают средствами защиты от действия активных форм кислорода. Эти реакции включают дисмутацию супероксид аниона в перекись водорода супероксиддисмутазой и конверсию перекиси водорода в воду каталазой.
| Реакции | Ферменты |
| H2O2+Cl– ––>OCl– + H2O | Миелопероксидаза |
| OCl – + H2O —> 1O2 +Cl–+ H2O | |
| 21O2 + 2H+ —> O2— + H2O2 | Супероксидисмутаза |
| H2O2 —> H2O + O2 | Каталаза |
4. Кислород-независимый внутриклеточный киллинг
Кислород-независмые механизмы внутриклеточного киллинга
| Эффекторные молекулы | Функции |
| Катионные белки (в том числе катепсины) | Повреждение микробных мембран |
| Лизоцим | Расщепляет мукопептиды в стенке бактерий |
| Лактоферрин | Лишает железа пролиферирующих бактерий |
| Протеолитические и гидролитические ферменты | Переваривание убитых бактерий |
5. Зависимый от оксида азота киллинг в реакциях неспецифического иммунитета
Связывание бактерий макрофагами, в частности, посредством Toll-подобных рецепторов, приводит к продукции ФНО-альфа, который аутокринно ( стимулирует те же клетки, которые его секретировали) индуцирует экспрессию гена индуцибельной NO синтазы (iNOS), в результате чего макрофаги синтезируют оксида азота (NO). Если клетка подвергается действию гамма-интерферона (IFN-гамма) , синтез оксида азота усиливается. Концентрация оксид а азота, освобождаемого макрофагами, обладает выраженным токсическим действием на микроорганизмы в непосредственной близости от макрофагов.