Определение и функции макрофагов
 Макрофаги (Mф) представляют собой эффекторные клетки врожденной иммунной системы, которые поглощают бактерии и выделяют цитокины (медиаторы) способствующие воспалению (провоспалительные) и противомикробные медиаторы. Кроме того, макрофаги играют важную роль в устранении пораженных клеток посредством запрограммированной гибели клеток (апоптоз, аутофагия и первичный некроз). Как правило, макрофаги поглощают и деградируют мертвые клетки, обломки, опухолевые клетки и инородные материалы. Они способствуют гомеостазу, реагируя на внутренние и внешние изменения в организме, а не только как фагоциты, но также через трофические, регуляторные и ремонтные функции. Недавние исследования продемонстрировали, что макрофаги дифференцируются из гемопоэтических стволовых клеток-моноцитов и эмбриональных макрофагов желточного мешка. Последние в основном являются тканевыми макрофагами.
Макрофаги (Mф) представляют собой эффекторные клетки врожденной иммунной системы, которые поглощают бактерии и выделяют цитокины (медиаторы) способствующие воспалению (провоспалительные) и противомикробные медиаторы. Кроме того, макрофаги играют важную роль в устранении пораженных клеток посредством запрограммированной гибели клеток (апоптоз, аутофагия и первичный некроз). Как правило, макрофаги поглощают и деградируют мертвые клетки, обломки, опухолевые клетки и инородные материалы. Они способствуют гомеостазу, реагируя на внутренние и внешние изменения в организме, а не только как фагоциты, но также через трофические, регуляторные и ремонтные функции. Недавние исследования продемонстрировали, что макрофаги дифференцируются из гемопоэтических стволовых клеток-моноцитов и эмбриональных макрофагов желточного мешка. Последние в основном являются тканевыми макрофагами.
Тканевые макрофаги в различных тканевых средах имеют гетерогенные фенотипы. Статья отражает фагоцитарные функции макрофагов, обеспечивающие врожденный иммунитет и гомеостаз тканей, роль тканевых макрофагов в нескольких патологических состояниях. Патогены (бактерии, вирусы, грибы) имеют на своей поверхности свойственные только им (специфические) молекулярные образы (PAMP). На врожденных иммунных клетках расположены рецепторы распознавания образов (PRR).
Центральную роль в распознавании клеток-хозяев и ответах на микробные патогены играют Toll-подобные рецепторы (TLR) распознавания образов. TLR распознают различные виды компонентов бактерий или вирусов как лиганды. Так, LPS (липополисахариды) — компонент клеточной стенки грамотрицательных бактерий, распознается комплексом TLR4-MD2; бактериальные липопептиды и пептидогликаны распознаются гетеродимерными TLR2 / TLR1 и TLR2 / TLR6.
Нуклеиновые кислоты (в фагосоме), такие как бактериальная геномная ДНК или вирусная РНК, могут быть распознаны TLR3, TLR7, TLR8 и TLR9.
Распознавание TLR соответствующих компонентов бактерий и вирусов включает внутриклеточные сигнальные пути, активирующие дифференцировку клеток воспаления в костном мозге, гены синтеза провоспалительных цитокинов. В дополнение к PRR, обнаруженным на клеточной мембране, существуют различные типы PRR в цитоплазме, включая NOD-подобные рецепторы (NLR), семейство рецепторов HIN-200 и RIG-1-подобные рецепторы (RLRs). Несколько NLR активируют каспазу-1,которая обостряет воспаление путем активации пироптоза — выраженной воспалительной формы запрограммированной гибели клеток путем некроза.RLR распознают вирусную двух цепочечную РНК и активируют сигнальные каскады синтезf интерферонов I типа и воспалительных цитокинов, которые индуцируют противовирусную иммунную реакцию.
Фагоциты — нейтрофилы, макрофаги и дендритные клетки — образуют мост между распознанными молекулярными образами бактерий и клеточными рецепторами.
В месте образования мостов мембрана фагоцитов выпячивается, окружает бактерии и поглощает их в фагосому, которая образуется при слиянии клеточной мембраны. Поскольку существует широкий спектр рецепторов фагоцитов, то существует множество сигнальных каскадов, которые могут быть активированы во время связывания рецептор-лиганд. Несколько растворимых молекул плазмы, называемых опсонинами, откладываться на поверхности патогенов и служат адаптерами, которые связывают и активируют мощные фагоцитарные рецепторы. Например, иммуноглобулин G (IgG), специфически связанный с микробными поверхностными антигенами, определяет связывание рецепторов (FcγRs) фагоцитов с Fc фрагментом антител. Молекулы C3b и iC3b системы комплемента связываться с мембранами патогенов, распознаются рецепторами фагоцитов.
 В дополнение к удалению чужеродных частиц, фагоцитоз важен для поддержания скорости обновления клеточных популяций в организме — каждый день миллиарды клеток умирают от апоптоза и их необходимо удалять. Механизм фагоцитоза апоптотических и неапоптотических клеток различен. Считается, что лучшим маркером апоптотических клеток является увеличение в сотни раз на их поверхности фосфатитилсерина (PS). У неапоптотических клетках PS локализован на внутренней стороне мембраны. Роль опсонинов апоптотических клеток выполняют ряд растворимых белков, в том числе молочный жировой глобулярный белок (MFG) -E8.
В дополнение к удалению чужеродных частиц, фагоцитоз важен для поддержания скорости обновления клеточных популяций в организме — каждый день миллиарды клеток умирают от апоптоза и их необходимо удалять. Механизм фагоцитоза апоптотических и неапоптотических клеток различен. Считается, что лучшим маркером апоптотических клеток является увеличение в сотни раз на их поверхности фосфатитилсерина (PS). У неапоптотических клетках PS локализован на внутренней стороне мембраны. Роль опсонинов апоптотических клеток выполняют ряд растворимых белков, в том числе молочный жировой глобулярный белок (MFG) -E8.
После поглощения в фагосому одним из нескольких способов стимуляции рецепторов, микробы и апоптотические клетки сразу же подвергаются кислород-зависимым и кислород-независимым атакам. Вскоре после абсорбции в фагосому NADPH-оксидаза продуцирует реакционноспособные виды кислорода (ROS), а фосфолипаза А2 — свободные жирные кислоты. После этого миелопероксидаза (МПО), различные гидролазы и лизосомы, такие как азурофильные гранулы, сливаются в фагосому и деградируют микробные или апоптотические клетки. Затем протонный насос понижает рН фагосомы, активируя сильную кислородзависимую микробицидную систему главным образом путем галогенирования, или независимую от кислорода микробицидную систему с основными белками и лизосомными ферментами. Необычно, макрофаги не содержат MПO, но имеют ионы Fe2+, которые образуют комплекс с аденозином с МПО активностью.
Макрофаги и дендритные клетки функционируют как антигенпредставляющие клетки (АПК). На молекулах основного комплекса гистосовместимости класса II они представляют пептидные антигены, полученные из переваренных бактерий и активируют Т-клетки хелперы – приобретенный иммунитет. В то время как макрофаги представляют свои антигены в тканях, дендритные клетки представляют пептидные антигены в лимфатическом узле. Только дендритные клетки могут активировать наивные Т-клетки в эффекторные Т-клетками и являются самыми мощными АПК.
Деградация патогенов высвобождает дополнительные лиганды, которые могут быть обнаружены рецепторами фаголисосомальной мембраны или цитозоля.
Происхождение макрофагов
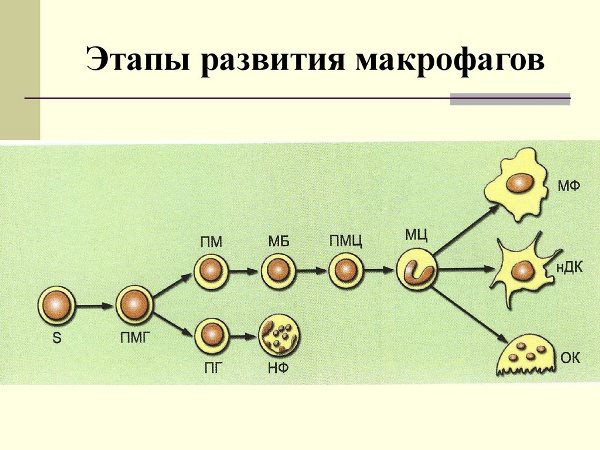
Макрофаги можно встретить почти во всех органах тела, включая печень, мозг, кости,и легкие; у них есть определенные функции в каждом органе. Например, альвеолярные макрофаги необходимые для процессинга сурфактантов, макрофаги желудочно-кишечного тракта и жировой ткани играют важную роль в поддержании гомеостаза. Каждый орган и его среда влияет на свойства макрофагов во время дифференциации. До недавнего времени считалось, что макрофаги тканей получены из гемопоэтических стволовых клеток и дифференцированы в тканеспецифические макрофагов в местных тканях. Однако японские исследователи показали, что мигрировавшие из эмбриональных желточных мешков в тот или иной орган плода макрофаги сохраняются в них путем самообновления, в дополнение к макрофагам полученным из гемопоэтических стволовых клеток.
Технические возможности последнего десятилетия позволили установить что
- почти вся микроглия в центральной нервной системе из эмбрионального желточного мешка и поддерживаются на протяжении всей жизни;
- в кишечном тракте сразу после рождения Мф,полученные из эмбрионального желточного мешка, заменяются макрофагами из моноцитов костного мозга;
- Мф, полученные из печени плода, доминируют в большинстве тканей,кроме центральной нервной системы и кишечного тракта.
- Мф, активированные инвазией патогенов для их уничтожения, классифицируются как M1 Мф; Мф, вызывающие хроническое воспаление при аллергических реакциях, заживлении ран, раке и метастазах классифицируются как M2 Мф.
- Как правило, PAMP и воспалительные цитокины, такие как TNF-альфа и IFN-γ индуцируют фенотип М1. И наоборот, противовоспалительные цитокины, такие как IL-10, IL-4 и IL-13 индуцируют фенотип М2.
- Как только в ткани инициируется воспалительная реакция, моноциты костного мозга проникают в ткань и дифференцируются в макрофаги или дендритные клетки.
- Считается, что макрофаги, полученные из эмбриональных источников, играют важную роль в поддержании гомеостаза ткани, а макрофаги, полученные из моноцитов костного мозга, связаны с защитными реакциями и воспалительными заболеваниями.