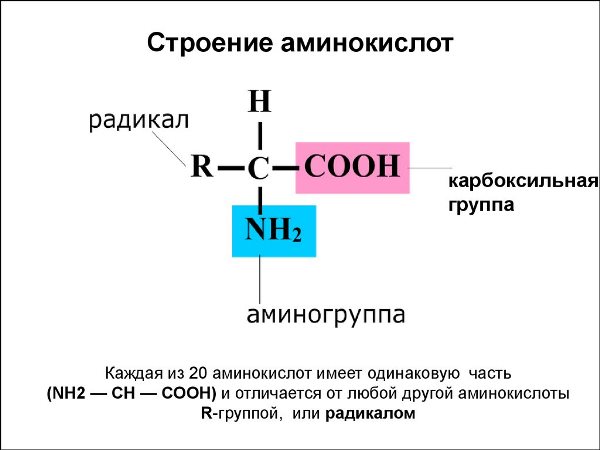
Аминокислоты (АК) — органические молекулы, которые состоят из основной аминогруппы (-NH2), кислотной карбоксильной группы (-СООН), и органической R радикала (или боковой цепи), которая является уникальной для каждой АК
Структура аминокислот
Функции аминокислот в организме
Примеры биологических свойств АК. Хотя в природе встречается более 200 различных АК только около одной десятой из них включаются в белки, другие выполняют иные биологические функции:
- Они строительные блоки белков и пептидов.
- Предшественники многих биологически важных молекул, производных АК. Например, тирозин является предшественником гормона тироксина и пигмента кожи меланина, тирозин также предшественник соединения ДОФА (диокси-фенилаланина). Это нейромедиатор передачи импульсов в нервной системе. Триптофан является предшественником витамина В3 — никотиновой кислоты.
- Источники серы — серосодержащие АК.
- АК участвуют во многих метаболических путях, таких как глюконеогенез — синтез глюкозы в организме, синтез жирных кислот и др.
В зависимости от положения аминогруппы относительно карбоксильной группы АК могут быть альфа, α-, бета, β- и гамма,γ.
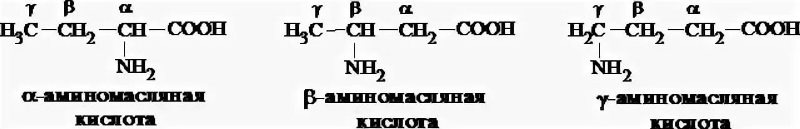
В состав белков в ходят только альфа-АК
Общие свойства альфа-АК белков
Оптическая активность
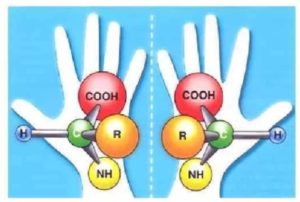 Все АК, за исключекнием глицина, проявляют оптическую активность, т.к. содержат по крайней мере один асимметричный атом углерода (хиральный атом).
Все АК, за исключекнием глицина, проявляют оптическую активность, т.к. содержат по крайней мере один асимметричный атом углерода (хиральный атом).
Что представляет собой асимметричный атом углерода? Это атом углерода, к которому присоединены четыре различных химических заместителя. Почему глицина не проявляет оптическую активность? В его радикале только три разных заместителя, т.е. альфа-углерод не асимметричный.
Что означает оптическая активности? Это означает, что АК в растворе может присутствовать в двух изомерах. Правовращающий изомер (+), который обладает способностью вращать плоскость поляризацованного света вправо. Левовращающий изомер (-), который обладает способностью вращать плоскость поляризации света влево. Оба изомера могут вращать плоскость поляризации света на одну ту же величину, но в противоположном направлении.
Кислотно-основные свойства
Все АК содержат по меньшей мере две ионизированных группы — альфа-аминогруппа и альфа-карбоксильная группа. Некоторые содержат в своей боковой цепи дополнительные кислотную или основную группу, которые отвечают за кислотно-щелочное поведение АК
В результате их способности к ионизации можно записать следующее равновесие этой реакции:
R-СООН R-C00— + H+
R- NH2 R-NH3+
Поскольку эти реакции обратимы это означает, что они могут действовать как кислоты (прямая реакция) или как основания (обратная реакция), что объясняет амфотерные свойства аминокислот.
Цвиттер ион
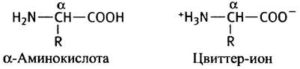 Все нейтральные аминокислоты при физиологическом значении рН (около 7,4) присутствуют как цвиттерионы — карбоксильная группа непротонированная и аминогруппа протонированная (рис.2). В растворах более основных, чем изоэлектрическая точка аминокислоты (ИЭТ), аминогруппа -NH3 + в АК жертвует протон. В растворе более кислом, чем ИЭТ АК, карбоксильная группа -СОО— в АК принимает протон. Таким образом, АК иногда ведет себя как кислота, в другие время как основание в зависимости от рН раствора.
Все нейтральные аминокислоты при физиологическом значении рН (около 7,4) присутствуют как цвиттерионы — карбоксильная группа непротонированная и аминогруппа протонированная (рис.2). В растворах более основных, чем изоэлектрическая точка аминокислоты (ИЭТ), аминогруппа -NH3 + в АК жертвует протон. В растворе более кислом, чем ИЭТ АК, карбоксильная группа -СОО— в АК принимает протон. Таким образом, АК иногда ведет себя как кислота, в другие время как основание в зависимости от рН раствора.
Полярность
При физиологическом рН АК присутствуют как цвиттер ионы.Положительный заряд несет альфа -аминогруппа, а отрицательный карбоновая. Таким образом, создаётся два противоволожных заряда с обеих концов молекулы АК, молекула имеет полярные свойства.
Наличие изоэлектрической точки (ИЭТ)
Значение рН, при котором чистый электрический заряд аминокислоты равен нулю, и, следовательно, она не может перемещаться в электрическом поле называется ИЭТ.
Способность поглощать в ультрафиолете
Фенилаланин, гистидин, тирозин и триптофан поглощают при 280 нм. На рис. оторажены значения молярного коэффициента экстинкции (ε) этих АК. В видимой части спектра аминокислоты не поглощают, следовательно, они бесцветны.

АК могут присутствовать в двух вариантах изомеров: L-изомера и D-изомера, которые являются зеркальными отражениями, и отличаются расположением химических групп вокруг атома α-углерода.
Все аминокислоты в белках в L-конфигурации, L-аминокиcлоты.
Физические свойства аминокислоты
Аминокислоты в основном водорастворимые, что объясняется их полярностью и наличием заряженных групп. Они растворимы в полярных и не растворяется в неполярных растворителях.
АК имеют высокую температуру плавления, что отражает наличие сильных связей, поддерживающих их кристаллическую решетку.
Общие свойства АК является общим для всех АК и во многих случаях определяются альфа-аминогруппой и альфа- карбоксильной группой. АК обладают и специфическими свойствами, которые диктуются уникальной боковой цепью.