Содержание:
Нейтрофилы
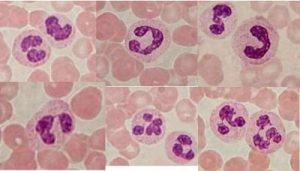 Активация и распознавание образов нейтрофильными гранулоцитами (часто обозначаемые ПЯЛ — полиморфноядерные лейкоциты) способны непосредственно распознавать и фагоцитировать многие бактерии, но не самые важные полисахаридно-капсулированные патогены. Эти агенты распознаются и фагоцитируются после опсонизации комплементом через рецепторы комплемента на нейтрофиле.
Активация и распознавание образов нейтрофильными гранулоцитами (часто обозначаемые ПЯЛ — полиморфноядерные лейкоциты) способны непосредственно распознавать и фагоцитировать многие бактерии, но не самые важные полисахаридно-капсулированные патогены. Эти агенты распознаются и фагоцитируются после опсонизации комплементом через рецепторы комплемента на нейтрофиле.
Как нейтрофилы находят свой путь из крови к месту их действия? С места инфицирования множество молекул диффундируют во всех направлениях, в конечном итоге достигая эндотелиальных клеток соседних сосудов. Эти молекулы включают LPS (липополисахарид) бактерий, C3a, C4a, C5a и сигнальные молекулы из первых локальных макрофагов, например хемокин IL-8, TNF и лейкотриен B4. Эндотелиальные клетки быстро реагируют на эти сигналы изменением картины экспрессии новых белков, таких как ICAM-1 и ICAM-2, на их мембранах, которые затем жестко связываются с контактными белками нейтрофилов и других лейкоцитов.
Нейтрофилы обычно перекатываются вдоль эндотелия динамическими контактами между углеводами сиалированного антигена Lex и белками селектинами на плазматической мембране эндотелия. Связывание ICAM с помощью ПЯЛ-интегринов приводит к внезапной остановке нейтрофилов. Они протискиваются между двумя эндотелиальными клетками и по хемотаксическому градиенту перемещаюся к очагу инфекции. Там нейтрофилы фагоцитируют и убивают бактерии. В процессе фагоцитоза они быстро умирают, поскольку суровые условия, необходимые для уничтожения бактерий, приводят к непоправимому повреждению клеток.(Кл) Их апоптотические тела поглощаются макрофагами.
Тучные клетки
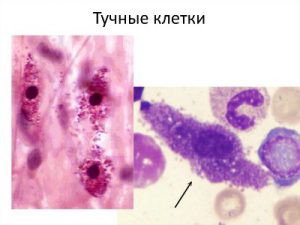 Активация тучных клеток (ТК). Тучные клетки при активации дегранулируют и высвобождают гистамин с помощью широкого спектра раздражителей: механического напряжения, включая царапины или разрывы, тепло, холод и, как следствие активации комплемента, C5a. Позже, после включения адаптивного иммунного ответа, ТК могут дегранулировать в ответ на сшивание рецепторов антителами типа IgE.
Активация тучных клеток (ТК). Тучные клетки при активации дегранулируют и высвобождают гистамин с помощью широкого спектра раздражителей: механического напряжения, включая царапины или разрывы, тепло, холод и, как следствие активации комплемента, C5a. Позже, после включения адаптивного иммунного ответа, ТК могут дегранулировать в ответ на сшивание рецепторов антителами типа IgE.
Эндотелиальные клетки и тромбоциты
Пути активации эндотелия и тромбоцитов. как Кл врожденного иммунитета. Эндотелиальные (ЭКл) представляют собой мезенхимальные Кл, костномозгового происхождения. Таким образом, предшественники ЭКл покидают костный мозг и попадают в места капиллярного роста или восстановления тканей. Их контроль осуществляет фактор VEGF (фактор роста сосудов). Обращенная в просвет сосудов поверхность ЭКл в нормальном состоянии предотвращает прилипание тромбоцитов и лейкоцитов, в то время как в активированном состоянии способствует свертыванию крови и экстравазации лейкоцитов.
Покоящиеся ЭКл покрыты густым гликокаликсом гликопротеинов и протеогликанов. Протеогликаны несут длинные боковые цепи гликозаминогликанов, такие как гепарансульфат. Их обильные полярных групп они связывают огромное количество воды, создавая скользящий слой для Кл и тромбоцитов. Общий объем гидратированного эндотелиального гликокаликса в нашем организме оценивается в 1,7 литра. Этот гель защищает Кл крови от механических повреждений.
Кроме того, многочисленные отрицательные электрические заряды, присутствующие как на гликокаликсе, так и на поверхности клеток крови, помогают предотвратить прилипание тромбоцитов и клеток крови.
Активация ЭКл. ЭКл реагируют как на механические, так и на химические сигналы. Хотя точные механизмы все еще обсуждаются, ЭКл способны ощущать деформацию напряжения сдвига, напряжения стенки сосуда или мышечную активность. Они также экспрессируют рецепторы для множества растворимых сигнальных молекул, включая гистамин, VEGF, TNFα, и реагируют на наибольшую опасность, связанную с их функцией, гипоксию.
Активация макрофагов и дендритных клеток через рецепторы распознавания образов
 Чтобы ощущать присутствие патогенов, макрофаги и дендритные клетки экспрессируют гораздо более широкий спектр рецепторов, чем нейтрофилы. Это рецепторы распознавания образов (PRR), которые распознают характерные для патогенов молекулярные структуры (PAMPS), которые они экспрессируют на своей поверхности.
Чтобы ощущать присутствие патогенов, макрофаги и дендритные клетки экспрессируют гораздо более широкий спектр рецепторов, чем нейтрофилы. Это рецепторы распознавания образов (PRR), которые распознают характерные для патогенов молекулярные структуры (PAMPS), которые они экспрессируют на своей поверхности.
Многие из рецепторов распознавания образов находятся на плазматической мембране.
- Одна группа рецепторов, лектины С-типа, распознает определенные единицы сахаров, которые обычно расположены в терминальном положении углеводных цепей на поверхностях патогенов. Лектины C-типа включают маннозный рецептор, а также DC-SIGN и лангерин, они характерны для дендритных клеток. «Маннозный рецептор» распознает терминальную маннозу, N-ацетиглюкозамин или фукозу, параллельно с маннан-связывающим лектином.
- Большая группа Toll-подобных рецепторов (TLRs) включает рецепторы для очень разных молекулярных структур патогенов (PAMPS). Так, TLR4 распознаёт бактериальный липополисахарид, TLR1/TLR2 и TLR2/TLR6 — бактериальные липопептиды и пептидогликаны; TLR5 связывает флагеллин, TLR9 — бактериальную ДНК, которая содержит метильные группы, отличные от человеческой ДНК. TLR3 активируется двухцепочечной РНК, типичной для вирусов, TLR7 и TLR8 — одноцепочечной РНК; полинуклеотидсвязывающий TLR распознаёт эндосомы бактерий.
Два других семейства рецепторов распознают PAMPS тогда, когда патогены попадают в цитоплазму.
- NOD-подобные рецепторы (NLR): NOD1 и NOD2, например, распознают компоненты пептидогликанов из клеточной стенки бактерий. При активации NLR образуют большой цитоплазматический комплекс инфламмасому, Инфламмасома способствует активации клеток и играет важную роль в образовании IL-1 и других цитокинов из их неактивных предшественников. В дополнение к PAMPs, некоторые продукты NLR воспринимают продукты, полученные из умирающих Кл, такие как кристаллы мононатриевого урата, метаболиты пурина, образующиеся в результате разрушения ДНК.
- RIG-подобные геликазы (RLH): цитоплазматическая РНК-геликаза RIG-I и родственные белки действуют как вирусные рецепторы. Они экспрессированы клетками всех типов, связывают двунитевую вирусную РНК свободным 5′-трифосфатным концом.
Рецепторы распознавания образов появились на ранней стадии эволюции. В течение длительных периодов времени они, похоже, были основным инструментом конкуренции многоклеточных организмов с бактериями. Например, геном морского ежа содержит более 200 генов для Toll-подобных и NOD-подобных рецепторов.
В дополнение к этим рецепторам распознавания образов (PRR), рецепторам комплемента, например, например, CR3 (CD11b / CD18) и CR4 (CD11c / CD18), иммунные клетки активируются C3-производными, депонированными на вторгающихся патогенах.
Активация этих рецепторов на макрофагах приводит к фагоцитозу и в большинстве случаев приводит к гибели и разрушению проглоченных бактерий. Кроме того, индуцируется глубокое изменение в программе экспрессии генов макрофагов, что приводит к высвобождению коктейля из цитокинов, включая IL-1, TNF, IL-6, IL-8 и IL-12, которые привлекают и активируют другие Кл системы обороны. Через кровоток эти цитокины попадают в печень, где запускают еще один инструмент неспецифической защиты — синтез белков острой фазы. При активации макрофаги и дендритные клетки также экспрессируют определенные, связанные с мембраной белки, например, B7-молекулы (CD80 и CD86), которые необходимы для инициирования адаптивного иммунного ответа.
Дендритные клетки
 В чем разница между макрофагами и дендритными клетками (ДК)? Макрофаги больше связаны с неадаптивной стороной защиты. Они представляют собой «оборудование для земляных работ», как следует из их названия, способные фагоцитировать большие количества твердых частиц.
В чем разница между макрофагами и дендритными клетками (ДК)? Макрофаги больше связаны с неадаптивной стороной защиты. Они представляют собой «оборудование для земляных работ», как следует из их названия, способные фагоцитировать большие количества твердых частиц.
ДК в основном находятся на адаптивной стороне защиты:
- их главная цель — собрать все виды антигенных материалов, доставить их в лимфатический узел и представить их Т-клеткам. Они способны фагоцитировать, но не делают тяжелую работу.
- Многие антигены поглощаются макропиноцитозом («пить много»), механизмом приема больших глотков окружающих жидкостей со всеми растворимыми антигенами.
- Третий способ ДК собирать антигены — это заражение вирусами, что важно для начала адаптивного противовирусного иммунного ответа.
Многие из наших ДК довольно долговечны, возникли на стадиях развития до рождения из гемопоэтических клеток в стенке желточного мешка или печени плода. Позднее дендритные клетки образуются в костном мозге. Дендритные клетки имеют две стадии жизни: функционально молодые, незрелые, бродят по периферии, собирают антигены, но не имеют инструментов для активации Т-клеток. Куда они идут, определяется хемокиновыми рецепторами, хемокины ведут в периферические ткани. Когда все благополучно, они целыми годами сидят в своих тканях-мишенях, но при инфекции макрофаги тотчас распознают её и освобождают хемокины, которые способствуют экспресии на ДК хоминг-рецептора CCR7,(В7). Теперь это зрелая ДК, способными перемещаться в ближайший лимфатический узел и представлять антигены Т-клеткам. Зрелые дендритные клетки утрачивают способность собирать антигены, но имеют все необходимое для продуктивной связи с Т-клеткам — много молекул МНС и В7. Секретируя хемокин CCL18, эти дендритные клетки привлекают в лимфатические узлы молодые, наивные Т-клетки.
Врожденные лимфоидные клетки
Наша врожденная система защиты содержит Кл, которые выглядят так же, как B или T-лимфоциты в микроскопе, но не экспрессируют ни рецепторы B, ни Т-клеток. Их называют врожденными лимфоидными клетками. Эти клетки могут быть активированы цитокинами, высвобождаемыми макрофагами или ДК, и способствуют немедленной защите. Наиболее изучены из этих типов клеток естественные киллерные клетки (NK клетки).
NK-клетки
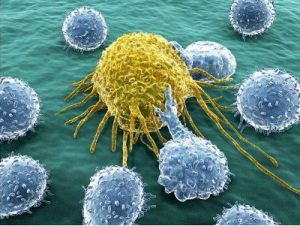 NK-клетки представляют собой лимфоциты врожденной иммунной системы, которые могут убивать массив клеток-мишеней и секретировать цитокины, которые участвуют в формировании адаптивного иммунного ответа и восстановлении тканей. Особенность NK-клеток заключается в их способности отличать измененные Кл (такие как опухолевые, инфицированные микробами, клетки, которые подверглись физическим или химическим повреждениям ) от нормальных клеток.
NK-клетки представляют собой лимфоциты врожденной иммунной системы, которые могут убивать массив клеток-мишеней и секретировать цитокины, которые участвуют в формировании адаптивного иммунного ответа и восстановлении тканей. Особенность NK-клеток заключается в их способности отличать измененные Кл (такие как опухолевые, инфицированные микробами, клетки, которые подверглись физическим или химическим повреждениям ) от нормальных клеток.
Как NK-клетки узнают мишени
Природные киллерные (NK) Кл сходны по внешнему виду и функционированию с цитотоксическими Т-лимфоцитами, но у них отсутствую рецепторы Т- клеток.. Как NK распознают клетки, которые должны быть убиты? Убиваю не моё!
Известно, что в организме все моё отмечено молекулами МНС I класса определенной структуры. NK -клетки экспрессируют два типа рецепторов: активирующие и ингибирующие. Ингибирующие рецепторы определяют присутствие нормальных молекул MHC-I на патрулирумых ими клетках. Клетка с нормальным MHC-I останются в покое. Если на клетке не содержится MHC-I или он видоизменен, то включается механизм активации NK-клетки и унижтожение «не моеЙ».
Кроме того, NK-клетки могут быть активированы альтернативными механизмами. В условиях клеточного стресса многие клетки экспрессируют такие белки, которые действуют как лиганды для активирующего NK-рецептора. В некоторых клетках это происходит в результате онкогенной трансформации. Высокие уровни экспрессии белка-лиганда активируют NK-клетки! NK-клетки могут быть активированы цитокинами, особенно IL-12. В свою очередь, NK-клетки секретируют цитокины в первую очередь интерфероны, которые действуют как стимул макрофагам.
Хотя NK-клетки являются частью неадаптивной иммунной системы, они также могут быть направлены на чужое антителами, и разрушать его с использованием механизма, называемом антителозависимой клеточной цитотоксичностью.