 Антитела — это белки, которые синтезируются иммунной системой организма в ответ на проникновение чужого, антигенов. Их задача – опознать и специфически связать антиген. Антигены — это бактерии, грибы, паразиты, простейшие и вирусы. В иммунной системе антитела называют гуморальными факторами адаптивного или приобретенного иммунитета. По своим свойствам антитела относятся к глобулинам. Глобулины, имеющие свойства антител, называют иммуноглобулинами.
Антитела — это белки, которые синтезируются иммунной системой организма в ответ на проникновение чужого, антигенов. Их задача – опознать и специфически связать антиген. Антигены — это бактерии, грибы, паразиты, простейшие и вирусы. В иммунной системе антитела называют гуморальными факторами адаптивного или приобретенного иммунитета. По своим свойствам антитела относятся к глобулинам. Глобулины, имеющие свойства антител, называют иммуноглобулинами.
В организме человека антитела находятся в двух физических формах – растворимой (кровь, тканевая жидкость, секреты) и связанной с наружной мембраной В-лимфоцитов. На мембране В лимфоцитов антитела выполняют функцию В клеточного рецептора, потому их называют рецепторные иммуноглобулины.
Рецепторные иммуноглобулины дают возможность В клеткам:
- обнаруживать и связывать антигены в попавшие в организм
- этот тип иммуноглобулинов обеспечивает связь внеклеточного пространства с внутриклеточными сигнальными путями, управляющими пролиферацией и дифференцировкой В клеток в секретирующие антитела плазматические клетки.
Растворимые антитела — продукт секреции плазматических клеток и выполняют следующие функции:
- нейтрализуют антиген,
- мобилизуют эффекторные клетки иммунной системы — клетки уничтожения чужого,
- связывают и активируют систему комплемента — систему белков врожденного иммунитета.
Иммуноглобулины — это бифункциональные белки. С одной стороны они взаимодействуют с небольшим количеством специализированные молекул — с Fc-рецепторами на клетках иммунной системы, белками комплемента и молекулами, инициирующими внутриклеточную сигнализацию. С другой стороны, они распознают бесконечное множество антигенных структур (детерминант).
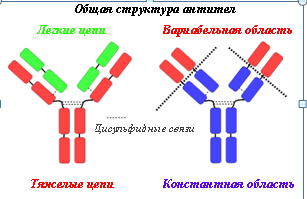
Молекулы как рецепторных, так и растворимых иммуноглобулинов, имеют общую основную структуру, которая имеет форму Y (рис.1). Эту структуру молекулы антител образуют две идентичные тяжелые цепи и две идентичные легкие цепи. N-концы легких и тяжелых цепей образуют вариабельную (предельно разную) область антител, F(ab)2 фрагмент — красные структуры на рис.1. образуют антиген связывающий сайт. Эта часть молекулы уникальна и называется детерминанта идиотипа (идиотип — класс иммуноглобулинов). У каждого человека 103 вариантов N-конца тяжелых и легких цепей образуют 106-107 вариантов антиген связующих сайтов. Особенности строения этой области обеспечивает распознавание бесконечного множества антигенных детерминант образования иммунных комплексов антиген-антитело (АГ-АТ).
Остальная часть легких и тяжелых цепей образуют константную область, Fc — фрагмент (синие структуры на рис.1). Эта область антител взаимодействует с ограниченным числом специализированных молекул на клетках иммунной системы, только с теми, которые имеют рецептор к Fc -фрагменту соответствующего класса иммуноглобулинов, и мобилизует их на уничтожение и удаление антигена.
F(ab)2 область антител выполняет:
- обнаружение антигена,
- осаждение антигена,
- блокирование активных центров токсинов или патоген-ассоциированных молекул;
- блокирование взаимодействия между молекулами клеток хозяина и патоген-ассоциированными молекулами возбудителя.
Но F(ab)2 не может:
- обеспечить ассоциированные с клетками воспалительные и эффекторные функции,
- обеспечить воспалительные и эффекторные функции комплемента,
- вовлечь антигены на путь процессинга. Эту функцию, она называется эффекторной, выполняет Fc- фрагмент антител..
Различают всего два варианта строения легких цепей иммуноглобулинов: каппа (κ) и лямбда (λ). В состав молекулы иммуноглобулинов входят либо лямбда, либо каппа. Структура тяжелых цепей антител имеет пять вариантов: µ,γ,α, ε и δ. В соответствии со структурой тяжелой цепи различают 5 классов иммуноглобулинов: IgM, IgG, IgA, IgE и IgD.
Классы иммуноглобулинов и их функция
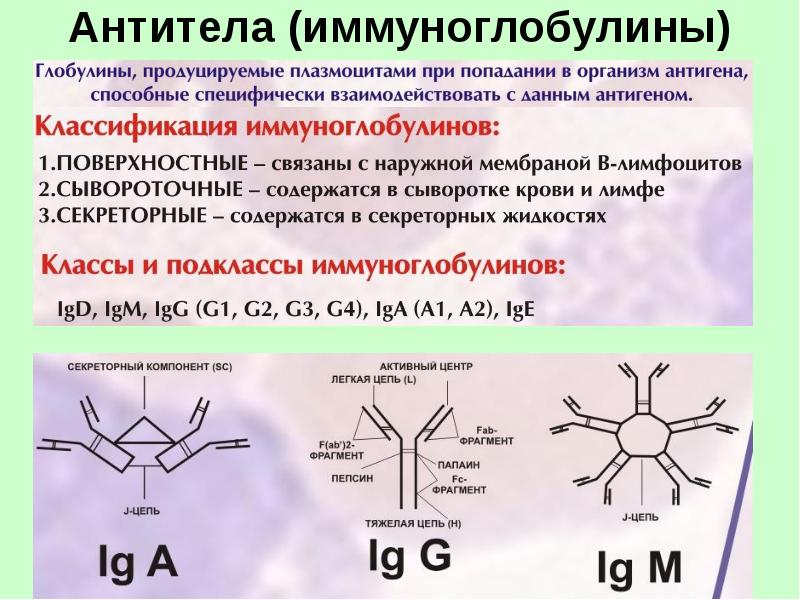
Молекула IgM является старейшим классом иммуноглобулинов. Это большая молекула, состоящий из пяти основных единиц вместе J-цепью. Основная роль IgM — внутрисосудистая нейтрализация организмов, особенно вирусов. Эта важная физиологическая роль определяется тем, что IgM содержит пять сайтов связывания комплемента, что приводит к мощной активации системы комплемента.
Эта активация (опсонизация) обеспечивает удаление комплексов антиген-антитело путем фагоцитоза через рецепторы комплемента на фагоцитирующих клетках или комплементарный лизис патогенов. Однако, в отличие от молекулы IgG, IgM имеет относительно низкую связь со специфическим антигеном. Во-вторых, из-за его размера он обычно не проникают в ткани.
Напротив, IgG представляет собой меньшую молекулу, которая легко проникает в ткани. IgG представлены четырьмя основными подклассами: IgG1 и IgG3 активирует комплемент и эффективно удаляют большинство белковых антигенов, включая удаление микроорганизмов фагоцитирующими клетками. Напротив, IgG2 и IgG4 реагируют в основном с углеводными антигенами и относительно слабые опсонины. IgG — единственная молекула, которая пересекает плаценту и обеспечивает специфическую иммунную защиту новорожденных (защитные антитела).
Основной иммуноглобулинов слизистой оболочки IgA, состоит из двух базовых единиц, соединенных J цепь. Добавление секреторной молекулы предотвращает переваривание IgA2 (sIgA) ферментами в слизистой и в кишечнике. Таким образом, IgA2 является основной молекулой IgA в секретах и весьма эффективен в нейтрализации антигенов,которые проникают через эти слизистые пути. IgA1, основная молекула IgA в сыворотке, однако, подвержена инактивации сывороточными протеазами и, следовательно, менее активна для защита. В настоящее время функция IgA1 неясна.
Антиген-специфические иммуноглобулины
Антигенсвязывающие сайты мембранных иммуноглобулинов В-клеток (рецепторы В-клеток) распознают не весь антиген, а определенные участки молекулы антигена, эпитопы или антигенные детерминанты с помощью конкретного домена вариабельных участков тяжелых (VH) и легких (VL) цепей. В -клетка активируется и подвергается пролиферации и дифференцировке. Последующее потомство этой В-клетки будет производить тот же домен VH или VL. Последовательность событий выглядит следующим образом: изначально B-клетка производит внутриклеточный антиген специфический IgM, который связан с поверхностью клетки. В-клетка теперь реагирует с антигеном и подвергается воздействию данного антигена.
В-клетка начинает продуцировать изотип или класс иммуноглобулинов и начинает делиться, и все потомство (клон) будет производить идентичные молекулы иммуноглобулина, специфически связывающиеся со своим антигеном.
Эти В-клетки позже созревают либо в плазматические клетки, либо в В-клетки.долговременной памяти.
Таким образом, антиген структура его поверхностных доменов (эпитопов) отбирает В-лимфоциты с комплементарными рецепторами, которые в конечном счете будут синтезировать антиген-специфические антитела, антитела к тому или иному патогену, белки которого индуцировали иммунный ответ. При первичной встрече с антигеном первыми синтезируются антиген-специфические IgM, через 7 -10 дней в сыворотке определяются антиген специфические IgG. При повторном инфицировании тотчас включаются В-клетки памяти и синтезируются антиген-специфические IgG.